| Indice del Artículo: |
Enlaces iónicos
Un enlace iónico se forma por la atracción de átomos o grupos de átomos con carga opuesta. Cuando un átomo (o grupo de átomos) gana o pierde uno o más electrones, forma un ion.
Los iones tienen una carga neta positiva o neta negativa. Los iones positivamente cargados son atraídos por el "cátodo" cargado negativamente en un campo eléctrico y se llaman cationes. Los aniones son iones con carga negativa nombrados como resultado de su atracción al 'ánodo' positivo en un campo eléctrico.
Cada enlace químico iónico se compone de al menos un catión y un anión.
La unión iónica se describe típicamente a los estudiantes como el resultado de la transferencia de electrón (s) entre dos átomos diferentes. La estructura de Lewis a continuación ilustra este concepto.
Para los sistemas atómicos binarios, la unión iónica típicamente ocurre entre un átomo metálico y un átomo no metálico. La diferencia de electronegatividad entre el átomo no metálico altamente electronegativo y el átomo de metal indica el potencial de transferencia de electrones.
El cloruro de sodio (NaCl) es el ejemplo clásico de enlace iónico. Sin embargo, la vinculación iónica no está aislada en sistemas binarios simples.
Un enlace iónico puede ocurrir en el centro de una gran molécula orgánica unida covalentemente tal como una enzima. En este caso, un átomo de metal como el hierro, se une covalentemente a grandes grupos de carbono y se une iónicamente a otros compuestos inorgánicos más simples (como el oxígeno).
Los grupos funcionales orgánicos, como el grupo de ácido carboxílico representado a continuación, contienen enlaces covalentes en la porción carboxilo del grupo (HCOO) que a su vez sirve como el anión del ion de hidrógeno ácido (catión).
Covalente
Un enlace químico covalente resulta del intercambio de electrones entre dos átomos con electronegatividades similares. Un único enlace covalente representa el intercambio de dos electrones de valencia (generalmente de dos átomos diferentes).
La siguiente estructura de Lewis , representa el enlace covalente entre dos átomos de hidrógeno en una molécula de H2.
Los múltiples enlaces covalentes son comunes para ciertos átomos dependiendo de su configuración de valencia. Por ejemplo, un enlace covalente doble, que se produce en etileno (C2H4), resulta del intercambio de dos conjuntos de electrones de valencia.
El nitrógeno atómico (N2) es un ejemplo de un enlace covalente triple.
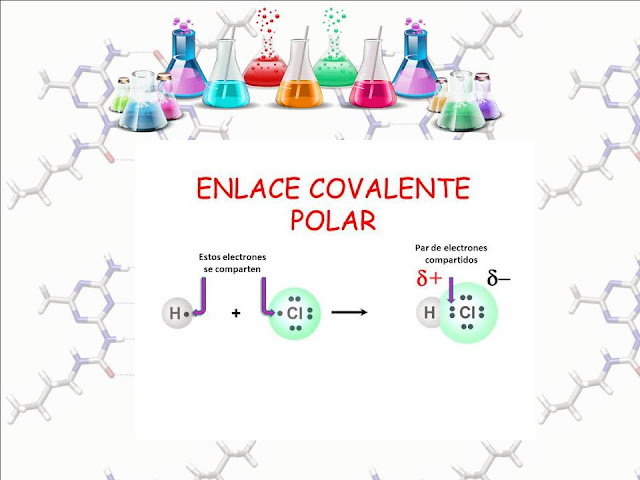
La polaridad de un enlace covalente se define por cualquier diferencia en electronegatividad en la que participan los dos átomos. La polaridad del enlace describe la distribución de la densidad de electrones, alrededor de dos átomos enlazados.
Para dos átomos enlazados con electronegatividades similares, la densidad electrónica del enlace se distribuye por igual entre los dos átomos. Este es un enlace covalente no polar.
La densidad electrónica de un enlace covalente se desplaza hacia el átomo con la mayor electronegatividad. Esto da como resultado una carga neta negativa dentro del enlace que favorece al átomo más electronegativo y una carga positiva neta para el átomo menos electronegativo.
Este es un enlace covalente polar.
Covalente coordinado
Se forma un enlace covalente coordinado (también llamado enlace dativo), cuando un átomo dona ambos electrones para formar un único enlace covalente. Estos electrones se originan del átomo donante como un par no compartido.
Tanto el ion amonio como el ion hidronio contienen un enlace covalente coordinado cada uno. Un par solitario en el átomo de oxígeno en el agua aporta dos electrones para formar un enlace covalente coordinado con un ion de hidrógeno para formar el ion hidronio.
Del mismo modo, un par solitario en nitrógeno contribuye con 2 electrones para formar el ion amonio. Sin embargo, todos los enlaces en estos iones son indistinguibles una vez formados.
Red Covalente
Algunos elementos forman moléculas muy grandes, formando enlaces covalentes.
Cuando estas moléculas repiten la misma estructura una y otra vez en toda la pieza del material, la unión de la sustancia se denomina red covalente.
El diamante es un ejemplo de carbono unido a sí mismo. Cada carbono forma 4 enlaces covalentes a otros 4 átomos de carbono , formando una molécula grande del tamaño de cada cristal de diamante.
Los Silicatos, [SiO 2 ] x , también forman estos enlaces covalentes de red. Los silicatos se encuentran en la arena, el cuarzo y muchos minerales.
Metálico
Los electrones de valencia de metales puros no están fuertemente asociados con átomos particulares. Esto es una función de su baja energía de ionización.
Se dice que los electrones en los metales están deslocalizados (no se encuentran en una región específica, como entre dos átomos particulares).
Como no están confinados a un área específica, los electrones actúan como un "mar" que fluye, moviéndose sobre los núcleos con carga positiva de los átomos de metal.
Dentro de las características más comunes que encontramos en los enlaces metálicos están:
• La deslocalización se puede usar para explicar la conductividad, la maleabilidad y la ductilidad.
• Debido a que ningún átomo en una muestra de metal tiene un fuerte control sobre sus electrones y los comparte con sus vecinos, decimos que están unidos.
• En general, cuanto mayor es el número de electrones por átomo que participan en la unión metálica, más fuerte es el enlace metálico.















No hay comentarios:
Publicar un comentario